研究内容の概略
1.高等植物の概日時計システム
単子葉類に属するアオウキクサ属(Lemna属)の植物には春から初夏にかけて開花する長日性の種と夏から秋にかけて開花する短日性の種が両方存在する。L. gibba(イボウキクサ)は前者に属し、L. paucicostata(アオウキクサ)は後者に属する(図1)。これら近縁の2種の時計関連遺伝子を同定し、その発現様式を調べた結果、CCA1/LHY, GI, TOC1, ELF3など、双子葉植物のシロイヌナズナにおいて振動体中枢を担うと考えられる遺伝子群の発現リズムは基本的に似ていることを示した(Miwa et al 2006)。つまり時計遺伝子の動きは短日・長日植物のみならず高等植物で保存されていることを示し、概日時計機構が高等植物で広く保存されている可能性を示した。
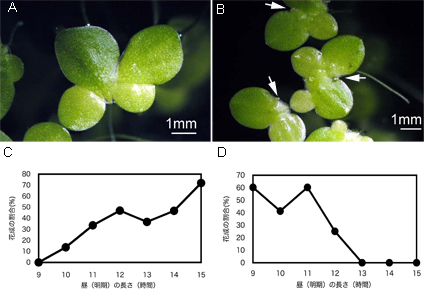 図1.Lemna属の長日性ウキクサと短日性ウキクサ
図1.Lemna属の長日性ウキクサと短日性ウキクサ(A) 長日性ウキクサL. gibba G3株。(B)短日性ウキクサL. paucisostata 6746株。(C)様々な日長条件におけるL. gibba G3株の花成の割合。24時間周期中の昼(明期)の長さに対して花成率をプロットしてある。(C)様々な日長条件におけるL. paucicostata 6746株の花成の割合。
光周性反応は季節変化に応じた花成時期制御に重要ですが、その性質は同一種内でも大きくことなることが知られています。様々な地域から取られたウキクサの仲間を材料に、種内の多様性や光周性反応そのものの多様性の理解に取り組んでいます。研究室で取得され、継代維持されているウキクサについては以下のマップにまとめられています。
2.生物発光レポーターを利用したウキクサの概日リズム測定系の開発と応用
概日リズムの研究では内在の時計の動きを観測することが必須となる。私たちはパーティクルガンを用いた一過的な遺伝子導入法をウキクサに応用することで、ルフェラーゼ遺伝子を発光レポーターとする生物発光リズム測定系を開発した。(Miwa et al. 2006)。この系では機能を知りたい遺伝子の過剰発現コンストラクトやRNAiコンストラクトをエフェクターとして共導入することで、遺伝子導入された細胞の概日リズムに対するエフェクターの影響を簡便に評価できる。この系を用いてウキクサの概日時計関連遺伝子の機能解析を行い、シロイヌナズナと対応する遺伝子は基本的に類似の機能を持ちうることを明示した(図2; Serikawa et al. 2008)。これらの研究により少なくとも高等植物においては概日時計システムの大枠は遺伝子のレベルで保存されていることが明らかになった。
さらに、この系を用いて細胞レベルの概日リズムのモニタリングに現在チャレンジしている(図2)。
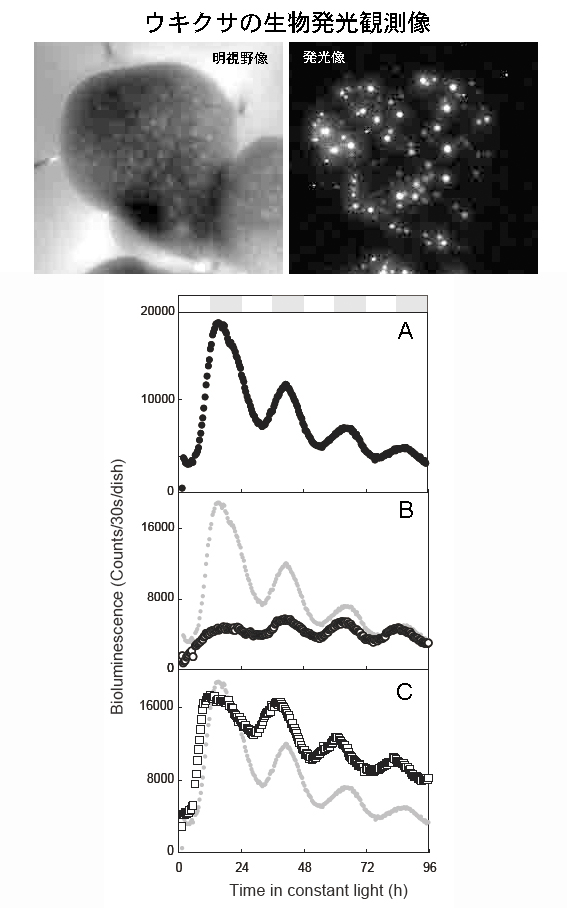
図2.生物発光レポーター系によるL. gibbaの生物発光像と概日リズムと時計関連遺伝子の機能解析
(Top) 発光レポーター導入後の超高感度カメラによるのL. gibba表面の発光観測像。(Bottom) (A)ウキクサにシロイヌナズナのPRR1遺伝子プロモーターとホタルルシフェラーゼ遺伝子の融合遺伝子を発光レポーターとして導入した。12時間の暗期で時計をリセットした後、連続明条件下で96時間生物発光量を測定した。夜に相当する時間が灰色で示してある。(B)ウキクサLHY遺伝子の過剰発現コンストラクトを共導入したときの生物発光。灰色のトレースはコントロール。(C)ウキクサLHY遺伝子のRNAiコンストラクトを共導入したときの生物発光。灰色のトレースはコントロール。コントロールと比較してピークの時間(位相)がはやくなっている。
3.シアノバクテリアの概日時計出力システム
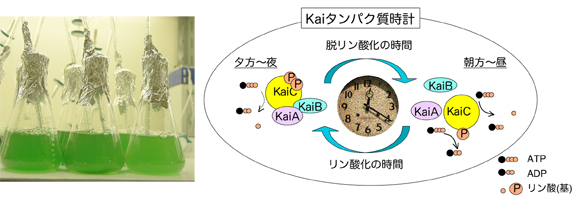
図3.シアノバクテリア概日時計システム
(A)シアノバクテリア(Synechococcus elongatus PCC 7942株)の培養の様子。(B)Kaiタンパク質時計の仕組み。KaiCのリン酸化・脱リン酸化が概日周期的に繰り返す。KaiA, KaiBとKaiCとの相互作用様式がリン酸化サイクルに共役して変動する。
シアノバクテリアの概日時計システムは三つの時計タンパク質(KaiA, KaiB, KaiC)を構成因子とする振動体を基盤とする。このKaiタンパク質振動体はATPを消費しながらKaiCのリン酸化・脱リン酸化、さらに複合体形成能を概日周期的に変動させている(図3;総説、小山 2008、Oyama 2009)。3つのKaiタンパク質の中でもKaiCが特に重要で、時計の基本的な性質(周期・外部温度に対する周期安定性・位相・同期)を規定していると考えられている(Terauchi et al. 2007、 Ito et al. 2007)。この振動体は精製タンパク質からなる試験管内の反応系でも機能する自律的なシステムであるが、細胞内で生理学的な役割を持つためには、振動体の時間信号を転写制御等へ伝達する出力システムが重要となる。Kaiタンパク質振動体の下流で概日リズム発現を示す遺伝子の中にはkaiB-kaiCオペロンがあり、振動体から転写促進と抑制の二つの信号が時刻依存的に交互にでていることが知られている(総説、小山2008)。分子遺伝学的な解析から、KaiCの量に応じて転写を抑制するネガティブフィードバックの経路にLabAが機能することを明らかにした(図4;Taniguchi et al. 2007)。一方、2成分制御系のセンサーキナーゼであるSasAはkaiB-kaiCオペロンの転写促進メディエーターであり、SasAはKaiCと直接相互作用する。KaiCがリン酸化反応性を持つときにその信号を下流の転写因子RpaAに直接伝えることが明らかになっている。LabAによる転写抑制信号もRpaAを介することを明らかにし、KaiCはリン酸化状態・反応性と濃度のの周期的な違いを時刻情報としてLabA, SasAの二つの因子に伝達し、それらの下流で働くRpaAを介して発現制御を行っていることを示した。さらに、2成分制御系のセンサーキナーゼであるCikAが新たな転写抑制経路で働くことを示し、LabA, SasA, CikAの3経路がKaiタンパク質振動体から転写制御へはたらく主要経路のすべてであることを証明した(図4;Taniguchi et al. 2010)。概日時計振動体から転写制御の全体図を明確に示した最初の例でとなった。
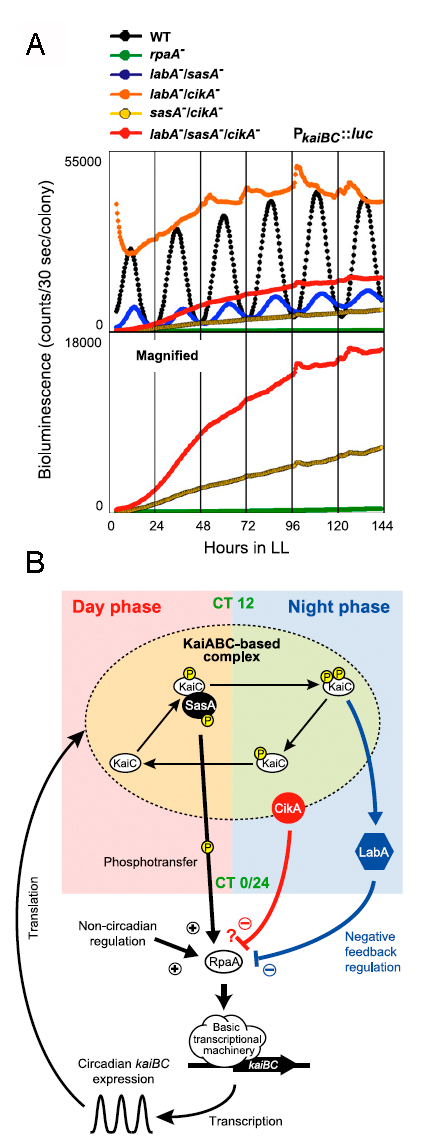
図4.シアノバクテリアの概日時計出力系多重変異体のリズム異常と機能相関モデル
(A) 出力系関連遺伝子(多重)変異体の連続明条件下でのkaiBプロモーターを持つ概日発光レポーターの活性変動。(B)Kaiタンパク質振動体の時間信号による転写(kaiB-kaiC オペロン)出力制御における時計関連因子の機能相関モデル。
シアノバクテリアの時計関連遺伝子をターゲットにゲノム配列データベースを解析すると、sasAオーソログはすべてのシアノバクテリアに見られるものの、一群の海洋性シアノバクテリアは転写抑制に働くlabAとcikAをともに持たないことが明らかとなった。つまりシアノバクテリアの中で時計出力システムは多様化していることが分かった。これらの海洋性シアノバクテリアはlabAのパラログであるllgAも持っていない。llgAの分子遺伝学的な解析から、llgAは概日転写制御に働くことができるが、その制御様式がlabAとは異なっているほか、llgAは細胞内代謝制御に大きく関与しうることを明らかにした(論文提出中)。
時計出力に関わる既知の転写抑制因子を持たない海洋性シアノバクテリアにおける転写出力システムの解明を通して、概日時計システムの成立過程に現在アプローチしている。